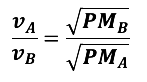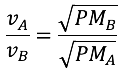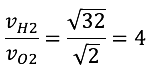Introducción
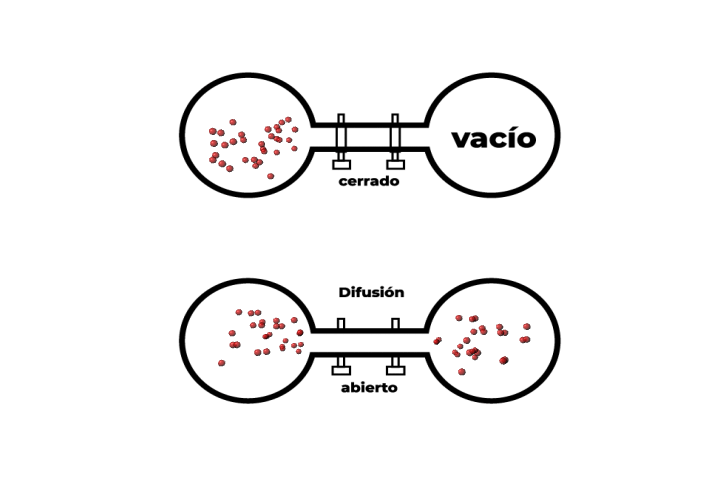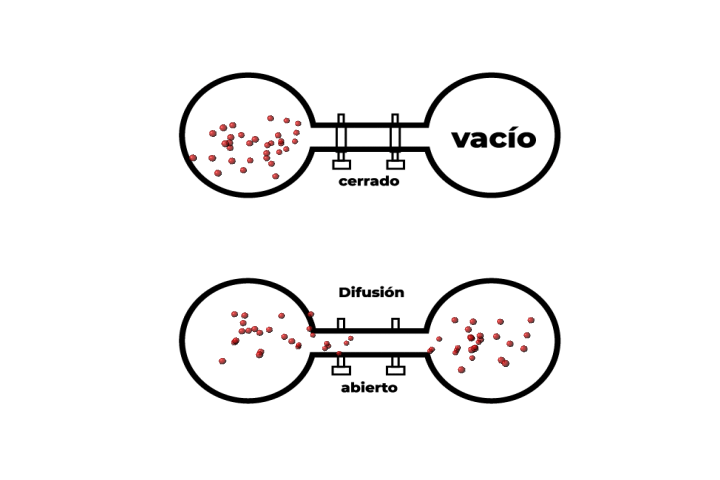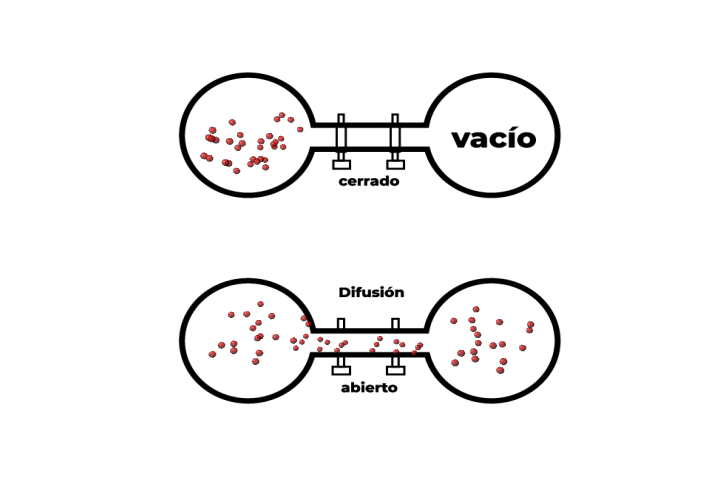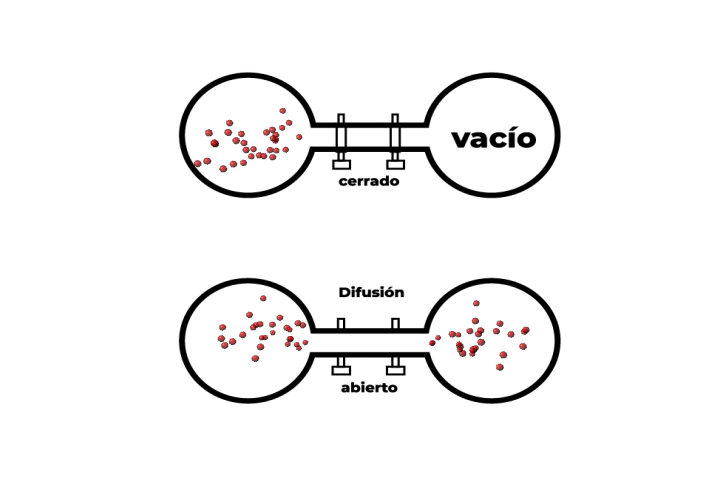
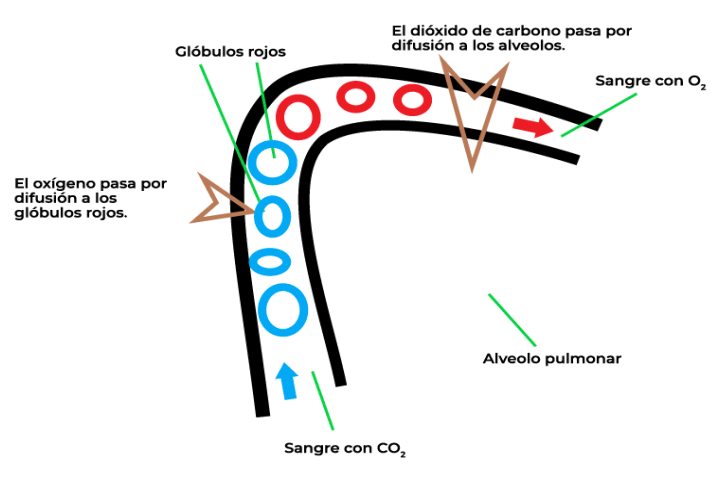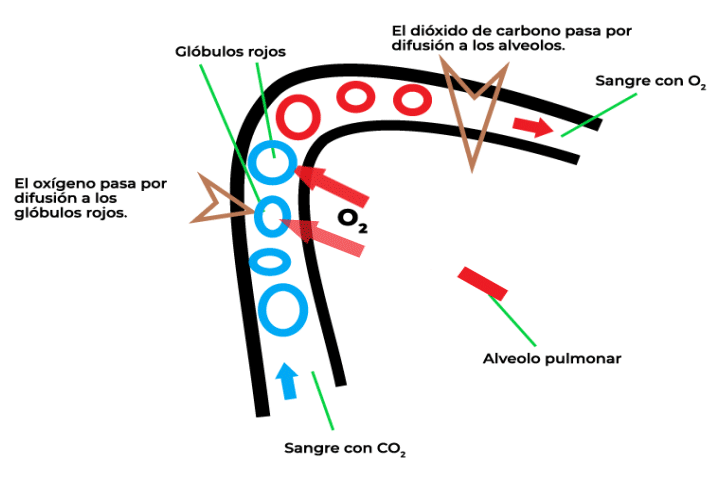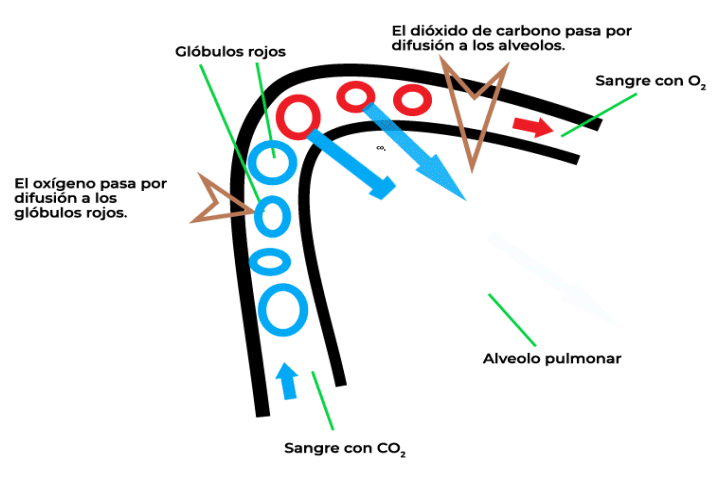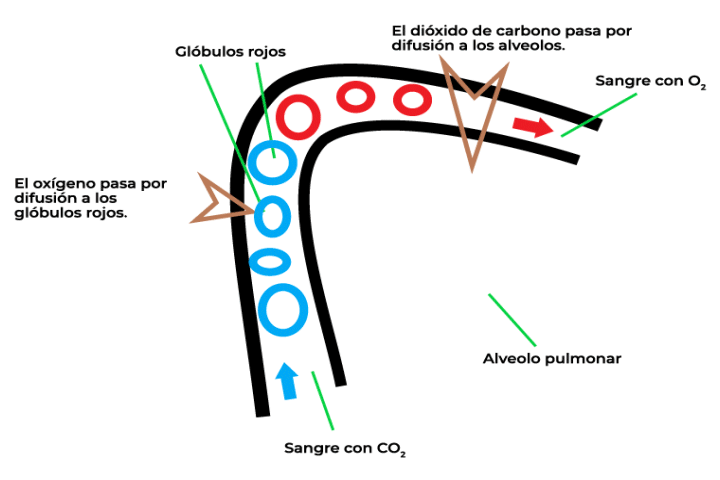
La ley de Graham se refiere a la velocidad de difusión entre dos gases, la cual está relacionada de manera inversamente proporcional con el peso molecular de cada gas. En la imagen, se muestra el proceso de intercambio de gases que se da en la respiración. Para poder respirar, al interior de los pulmones, se realizan distintos procesos que permiten trasladar el oxígeno y el dióxido de carbono. La velocidad de difusión de estos gases se puede calcular mediante el uso de la ley de Graham.
En esta unidad, cuya duración es de una hora, se revisará la ley de Graham de la difusión de dos gases de diferente peso molecular.